01.06.2020. Hoy, uno de junio, se celebra el día nacional de la prevención contra la leishmaniosis. Hablamos con el centro VISAVET y los diferentes grupos de investigación del Departamento de Sanidad Animal de la Facultad de Veterinaria de la Universidad Complutense de la Madrid especializados en esta enfermedad y miembros de la Red RISA.
Hoy es el día nacional de la prevención contra la leishmaniosis, una de las enfermedades parasitarias más importantes del mundo, que a pesar de ocupar el segundo lugar detrás de la malaria en términos de mortalidad, sigue siendo una enfermedad tropical desatendida (NTD).
La leishmaniosis es una enfermedad zoonósica y endémica en 98 países, incluyendo América, Asia, África y la cuenca mediterránea. En el centro y norte de Europa se considera una enfermedad emergente, principalmente debido a cambios climáticos y fenómenos de globalización que han propiciado el movimiento de vectores y reservorios. Está producida por protozoos parásitos del género Leishmania, siendo la especie presente en el área mediterránea Leishmania infantum.
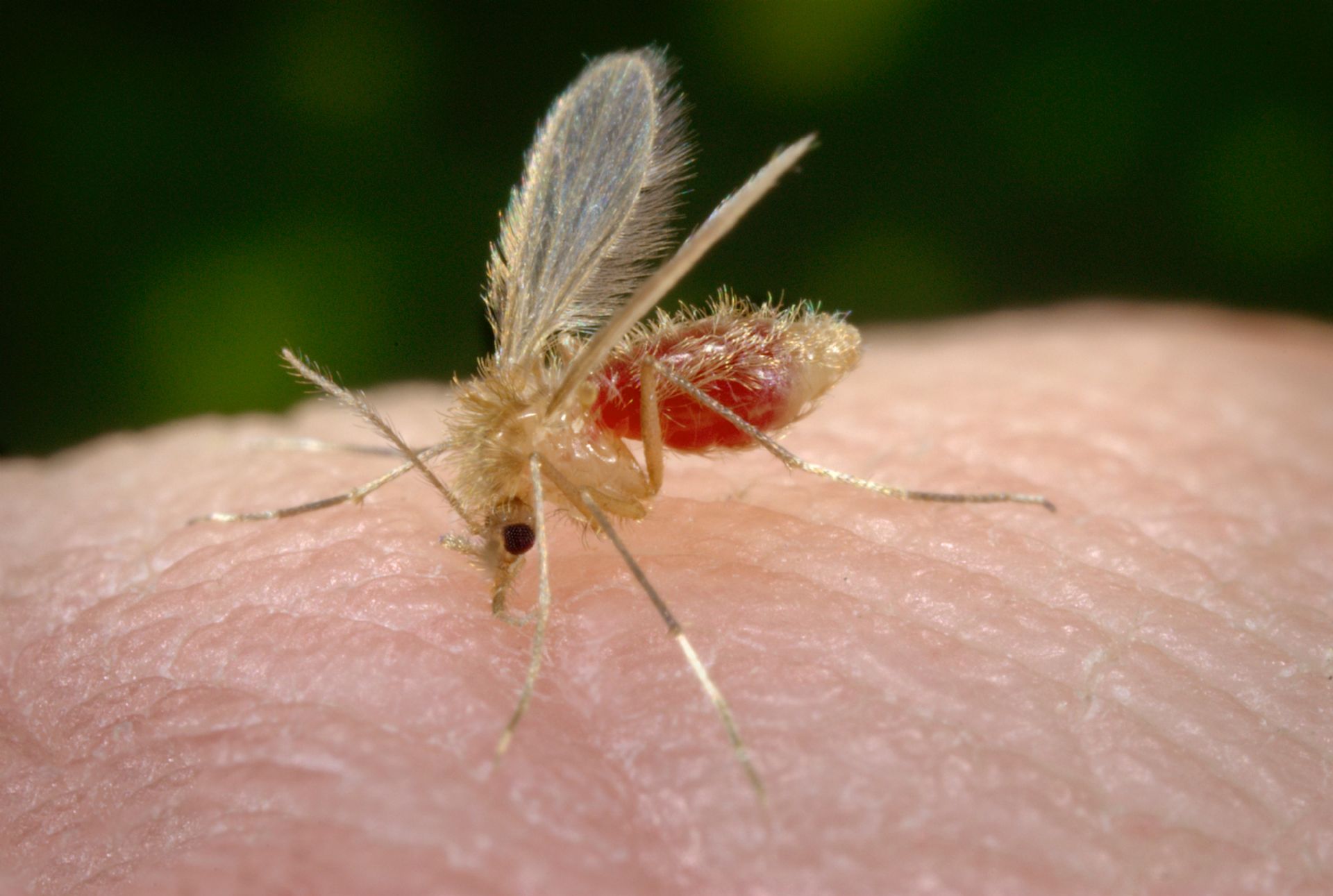
La leishmaniosis se transmite principalmente por la picadura de vectores infectados, concretamente de insectos dípteros llamados flebotomos. Estos son pequeños (1.5 mm a 3,5 mm), peludos y de color amarillento. Su actividad es mayor al anochecer y al amanecer y se sienten atraídos por la luz. Las principales especies encontradas en España son Phlebotomus perniciosus y P. ariasi. Durante el día no son visibles, permanecen en grietas como huecos de árboles, vertederos, alcantarillas, casas en ruinas, etc. En España los flebotomos tienen una actividad estacional que generalmente va de mayo a octubre. Sin embargo, en los últimos años este periodo se ha extendido debido al aumento de las temperaturas.
Esta enfermedad es muy conocida por los veterinarios, ya que el perro es considerado su principal reservorio. En una gran mayoría de los animales la leishmaniosis cursa de forma subclínica. Sin embargo, se puede producir enfermedad grave con signos clínicos variables: alopecia, pérdida de peso, linfadenomegalia, crecimiento exagerado de las uñas (onicogriposis), lesiones cutáneas, atrofia muscular, letargia, cojera o inflamación articular, epistaxis, etc. En algunos perros pueden producirse cuadros graves de enfermedad renal crónica.
Aunque el perro es el reservorio principal de la leishmaniosis, hay otros animales como liebres y conejos, cabras, roedores, gatos, marsupiales, primates, e incluso aves en los que se ha detectado la presencia del parásito. Sin embargo, es importante realizar estudios para determinar si son verdaderos reservorios y transmisores de la enfermedad.
Los humanos se contagian principalmente al ser picados por flebotomos infectados con el parásito. Para que el vector se infecte ha de picar previamente a un hospedador infectado. Hay tres formas clínicas principales de leishmaniosis humana: cutánea (LC), mucocutánea (LMC) y visceral (LV). La leishmaniosis visceral o kala-azar es endémica, entre otras regiones, en la cuenca mediterránea y es la forma más grave de enfermedad, presentando una alta tasa de mortalidad cuando no se trata.
En los últimos años la leishmaniosis ha cobrado gran importancia en nuestro país debido a la aparición de un gran brote en la Comunidad de Madrid (desde el año 2009), asociado a reservorios diferentes al perro, principalmente a los lepóridos (liebres y conejos). Se trata del mayor brote de leishmaniosis humana conocido en Europa, que hasta la fecha ha afectado a más de un millar de personas. El origen de este brote es multifactorial, principalmente debido a la sobrepoblación de lepóridos en la zona y la elevada densidad de flebotomos favorecida por los cambios urbanísticos que transformaron un área rural en un parque urbano.
En este sentido son varios los grupos de investigación dentro de la red RISA que trabajan en muy diversos e interesantes aspectos relacionados con la leishmaniosis, desde estudios de patogenia, nuevos agentes terapéuticos, estudios de prevalencia, reservorios silvestres, etc. Resumimos a continuación algunos de ellos.

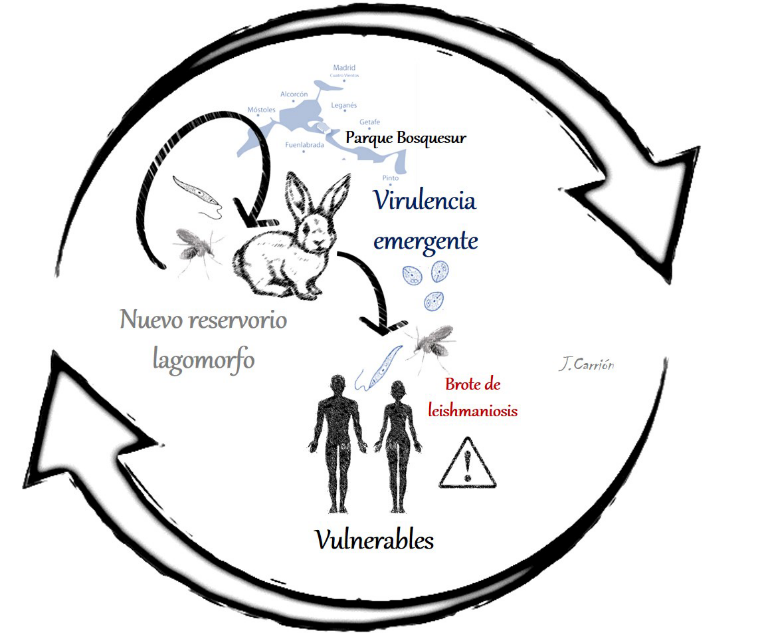
En el mundo moderno, desde una perspectiva evolutiva y en el contexto de los recientes acontecimientos derivados de la última pandemia vírica, queda en evidencia nuestra vulnerabilidad ante el desconcertante proceso de aparición de nuevas propiedades virulentas de agentes infecciosos. Esta virulencia emergente es impredecible y es consecuencia en muchas ocasiones de nuevas interacciones parásito-hospedador. Un ejemplo de ello es el brote de leishmaniosis humana en Madrid. Las consecuencias derivadas de la interacción de L. infantum y sus nuevos reservorios lagomorfos dentro del parque forestal de Bosquesur es objeto de los recientes estudios del grupo de investigación Infectología microbiana veterinaria (InMiVet) de la UCM.
Sus últimos hallazgos apuntan a que el parásito ha incrementado su fenotipo virulento debido a que la relación patógeno-hospedador es tan reciente que no ha habido tiempo aún de coevolucionar hacia una situación de equilibrio. Esto ha propiciado que, en el momento de cruzar la barrera interespecífica, los seres humanos sean vulnerables a la enfermedad, independientemente de su estatus inmunológico. Así lo corroboran los resultados obtenidos en ensayos de infección experimental en hámster y ratón. Aquellos aislados parasitarios procedentes de flebotomos capturados en el área del foco infeccioso en Madrid, presentan una enorme capacidad de diseminación metastásica y de afectación inflamatoria de órganos viscerales, según la interpretación de los biomarcadores analizados y comparados con cepas parasitarias de referencia bien caracterizadas.
En la leishmaniosis visceral zoonósica (LVZ) por L. infantum, el control de la enfermedad requiere de forma obligada el control de la leishmaniosis canina, principal reservorio, y constituye un ejemplo de la necesidad de aplicar el marco integrador “One Health”. Para el control de esta enfermedad tan relevante en sanidad animal y humana, es necesario invertir en I+D+i para incrementar la disponibilidad de medicamentos frente a la leishmaniosis, que sean seguros, de calidad y eficacia, así como encontrar nuevas entidades químicas (NEQ) en la industria farmacéutica.
El grupo de Investigación y Control de Parasitosis en Veterinaria (ICPVet) de la UCM se ha centrado en dos aspectos críticos en el descubrimiento de fármacos: 1) expansión del espacio químico, y 2) modelos subrogados predictivos. La eficacia de la selección de moléculas no ha mejorado desde los primeros pasos de la quimioterapia antiparasitaria a pesar de nuestro conocimiento de la biología del agente, de la aplicación de Sistemas de Cribado de Alta capacidad y basadas en la identificación de dianas, y las cuantiosas inversiones. La propuesta de ICPVet utiliza una estrategia pragmática mixta (“modelo reticular”). Por ello, la exploración de alternativas terapéuticas se desarrolla mediante: a) Evaluación de seguridad y toxicidad de moléculas en modelos fenotípicos adecuados; b) Reevaluación del valor de las dianas terapéuticas (“on target” vs. “off target); c) Validación de sistemas de cribado; d) Criterios de selección de modelos in vitro, ex vivo e in vivo adecuados (inmunología, patología, eficacia); e) Criterios más restrictivos (IC90) en la selección de moléculas; f) Caracterización temprana de PK / PD, en el modelo adecuado. Este sistema se ha utilizado con moléculas de origen natural y sintéticas, de diferentes familias químicas, en un roedor de alto valor predictivo (criceto) y en perro. Su aplicación ha permitido la identificación de una molécula, de baja toxicidad, adecuados parámetros PK/PD y alta eficacia frente a L. infantum. Estas investigaciones han sido llevadas a cabo especialmente por M.J. Corral, M.D. Jiménez-Antón y A.I. Olías-Molero.
En las últimas décadas, la epidemiología de la leishmaniosis por L. infantum ha sufrido importantes cambios, relacionados tanto con la distribución del vector como con los reservorios.
· El perro, el reservorio principal
El Grupo de investigación de la UCM EPICONTROL-Carnívoros, colabora desde 1996 con la Sección de Zoonosis y Riesgos Biológicos de la Consejería de Sanidad de la Comunidad de Madrid en el Plan de Vigilancia y Control de la leishmaniosis canina, dentro del Programa de Prevención y Control de Riesgos Ambientales. El objetivo principal de este programa ha sido conocer la seroprevalencia de L. infantum en los perros vagabundos alojados en Centros de Protección Animal, considerados como centinelas de la infección por L. infantum. El análisis de los factores de riesgo asociados a estas poblaciones caninas contribuirá a realizar un adecuado control de la leishmaniosis. Los resultados de las investigaciones de EPICONTROL-Carnívoros indican que la seroprevalencia de L. infantum no ha aumentado de forma significativa durante los últimos 24 años en la Comunidad de Madrid; sino que se manifiesta estable e incluso ha descendido considerablemente. Estos resultados forman parte de la tesis doctoral de Aurora Muller que la defenderá en el año en curso.
Así mismo, durante el desarrollo del brote de leishmaniosis humana surgido en la Comunidad de Madrid este grupo de investigación se planteó analizar si esta situación estable de seroprevalencia en el perro hubiera cambiado. Se analizaron tres poblaciones caninas establecidas en función del riesgo de exposición: de alto riesgo (perros vagabundos y perros de caza) y de bajo riesgo (perros de propietario con aplicación de repelentes regularmente) y poblaciones de gatos vagabundos. Los resultados obtenidos demostraron de nuevo que el perro no estaba teniendo ningún impacto en la justificación del brote de la enfermedad en el hombre ni tampoco el gato.

· El conejo y la liebre silvestre
Aunque el perro sigue considerándose el reservorio principal, existen en la actualidad otros reservorios en los que han demostrado la infección y que pueden tener un papel importante a la hora de establecer adecuadas medidas de control. El Servicio de Zoonosis Emergentes, de Baja Prevalencia y Agresivos Biológicos (NED) del Centro VISAVET de la UCM lleva colaborando también desde el año 2009 con la Sección Zoonosis y Riesgos Biológicos de la Consejería de Sanidad de la Comunidad de Madrid y en muy estrecha colaboración con el Instituto de Salud Carlos III (ISCIII). Principalmente se han llevado a cabo estudios relacionados con reservorios silvestres en el brote de la Comunidad de Madrid, que se encuadran en la tesis doctoral de María Victoria Ortega García.
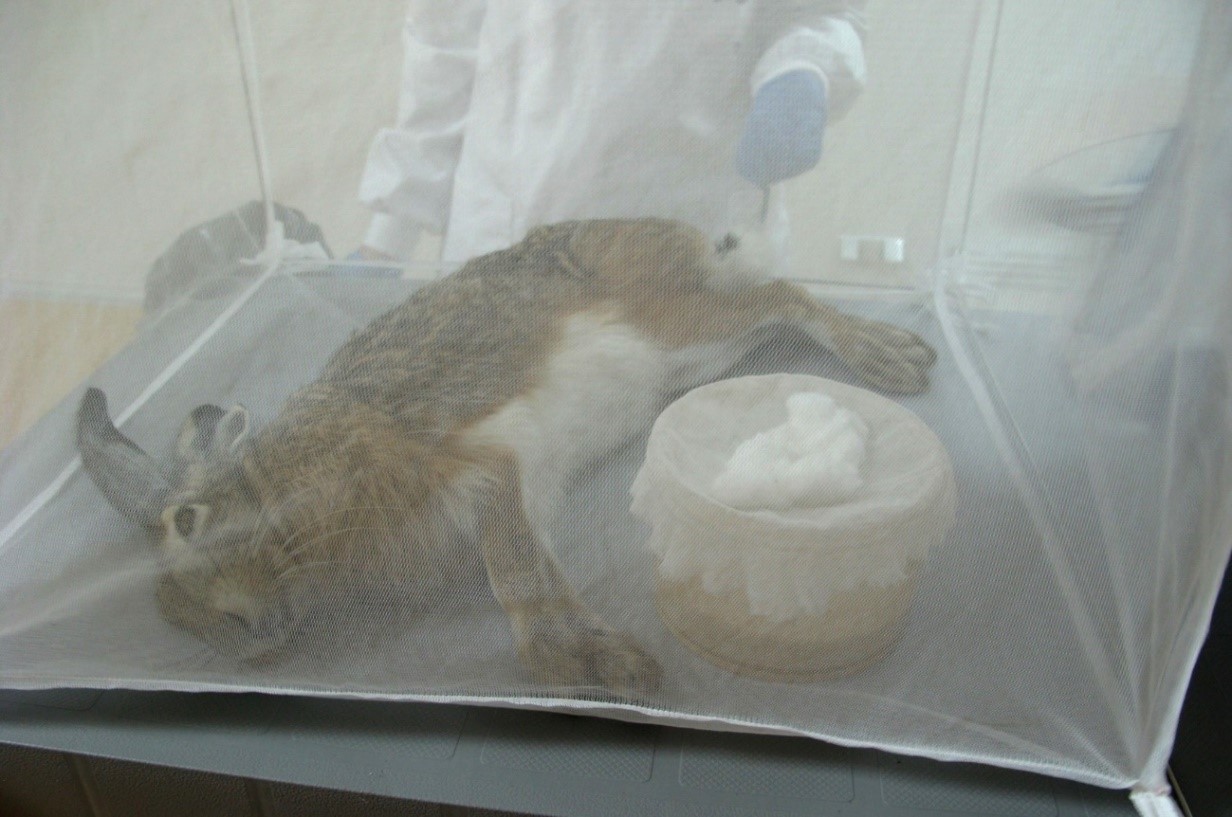
Se ha podido determinar que en este brote se describió por primera vez un nuevo ciclo de transmisión selvático en el que en las liebres y los conejos eran los reservorios competentes y origen de la enfermedad en humanos. Para su demostración se han realizado distintos estudios que incluyen el xenodiagnóstico (exposición a la picadura de flebotomos procedentes de una colonia experimental), la implementación y optimización métodos de diagnóstico en estos animales silvestres y estudios de anatomopatológicos.
Mediante un análisis bayesiano se demostró que la técnica de inmunofluorescencia indirecta (IFI), que detecta anticuerpos, es una herramienta sensible y específica para el diagnóstico de leishmaniosis en conejos y liebres, y que puede ser útil en estudios de vigilancia epidemiológica. Además, se puso a punto esta técnica en muestras de exudado hepático (ya que la obtención de suero es muchas veces complicada en estos animales) y se pudo demostrar la elevada prevalencia en liebres y conejos de la zona del brote. También se utilizó una PCR en tiempo real para detectar el parásito en diversas muestras, incluyendo el pelo, una muestra fácil de obtener y de transportar y no invasiva.
Por otra parte, y en colaboración con la Universidad de Surrey (Reino Unido), se ha utilizado la técnica de la fluorescencia directa e histopatología para demostrar que la infección por L. infantum apenas produce lesiones en lepóridos silvestres, como ocurre en otros animales de vida libre, y que los amastigotes se encuentran diseminados por distintos tejidos de los animales, incluso en la piel. Todos estos estudios demuestran que liebres y conejos pueden actuar como portadores asintomáticos de la leishmaniosis en determinados escenarios epidemiológicos. Por lo tanto, es fundamental vigilar y controlar estas poblaciones animales.
· Primates y marsupiales como potenciales reservorios
Ente los nuevos reservorios de la leishmaniosis se encuentra la fauna salvaje cautiva en parques de la Comunidad de Madrid. Hasta el momento el grupo EPICONTROL-Carnívoros ha detectado la infección por L. infantum en grandes simios y en marsupiales.
En 2014, tras la muerte súbita de dos ejemplares de wallaby de Bennet en un parque temático de la Comunidad de Madrid, este grupo de investigación demostró que la causa de la muerte había sido una infección masiva de L. infantum, y posteriormente analizando otros ejemplares vivos del parque se demostró que eran también positivos. En 2017 detectó, casi de forma simultánea, dos orangutanes (alojados en diferentes centros) con un cuadro compatible con leishmaniosis que fue confirmada por diagnóstico molecular, análisis serológicos y alteraciones clínico-patológicas. Así mismo el xenodiagnóstico en uno de los dos ejemplares resultó positivo lo que corrobora la importancia de estos hallazgos.
EPICONTROL-Carnívoros en la actualidad está investigando, en colaboración con estos centros, la infección en otras especies de animales salvajes, principalmente grandes felinos, primates, así como distintas especies de carnívoros. Los resultados obtenidos contribuirán a un mejor conocimiento de la epidemiología de esta importante zoonosis en el área de la Comunidad de Madrid.

· Leishmania en murciélagos
L. infantum ha demostrado ser un parásito capaz de adaptarse a nuevos hospedadores. La presencia y prevalencia del parásito en nuevos reservorios silvestres como el murciélago está siendo investigada por Iris Azami Conesa, del Departamento de Sanidad Animal de la UCM en colaboración con el Grupo de Rehabilitación de la Fauna Autóctona y su Hábitat (GREFA) (www.grefa.org). Los primeros resultados muestran que el murciélago común (Pipistrellus pipistrellus) podría actuar como reservorio de L. infantum, ya que se encontró ADN del parásito en bazo, pelo y sangre de los primeros ejemplares analizados procedentes de la Comunidad de Madrid. El papel de otras especies de quirópteros ha sido señalado en algunas zonas del mundo, pero nunca antes en murciélagos peridomésticos de Europa.
Finalmente destacar que es fundamental intensificar las investigaciones y llevar a cabo una vigilancia epidemiológica del parásito, del vector, así como de los posibles reservorios para poder implementar las consecuentes medidas de prevención control mediante la colaboración interdisciplinar de distintas instituciones y grupos de investigación.
Más información: stopleishmania.org Collaborative initiative for information about leishmaniosis prevention and control.

Autores:
Nerea García1,3, José María Alunda2,4, Iris Azami-Conesa2,8, Javier Carrión2,5, Ana Doménech2,6, Gustavo Domínguez-Bernal2,5, María Teresa Gómez-Muñoz2,3, Sergio González1,3, Lucía de Juan1,2,3, Guadalupe Miró2,7, Aurora Muller2,7, Ana Isabel Olías-Molero2,4 y María Victoria Ortega-García9.
1. Centro VISAVET. Universidad Complutense de Madrid.
2. Departamento de Sanidad Animal. Facultad de Veterinaria. Universidad Complutense de Madrid.
3. Grupo de investigación Vigilancia Sanitaria. Universidad Complutense de Madrid.
4. Grupo de investigación Investigación y Control de Parasitosis en Veterinaria (ICP-Vet). Universidad Complutense de Madrid.
5. Grupo de investigación Infectología microbiana veterinaria (InMiVet). Universidad Complutense de Madrid.
6. Grupo de investigación Virus Animales. Universidad Complutense de Madrid.
7. Grupo de investigación EPICONTROL-Carnívoros. Universidad Complutense de Madrid.
8. Grupo de Rehabilitación de la Fauna Autóctona y su Hábitat (GREFA).
9. Instituto Nacional de Técnica Aeroespacial (INTA). Campus La Marañosa.
