
Ana Balseiro1, Ignacio García-Bocanegra2, José Francisco Ruiz-Fons3, Christian Gortázar3
1 Universidad de León; Instituto de Ganadería de Montaña (IGM-CSIC-ULE)
2 Grupo de Investigación en Sanidad Animal y Zoonosis (UIC-ENZOEM-UCO)
3 SaBio-IREC (CSIC-UCLM)
Las enfermedades emergentes o re-emergentes se han incrementado exponencialmente en las últimas décadas, suponiendo un creciente problema para la salud pública, la sanidad animal y la economía a nivel global, así como para la conservación de la biodiversidad. Entre los factores implicados en la emergencia de patógenos destacan (1) el incremento del transporte internacional de bienes, animales y personas fruto de la globalización, (2) el aumento de la población humana y los consiguientes cambios en los usos del suelo, en gran medida dirigidos a las producciones agrícolas y ganaderas para cubrir la creciente demanda de alimentos, y (3) los cambios en las comunidades de patógenos, en los propios patógenos o en su espectro de acción. La actividad humana provoca cambios en los ecosistemas que derivan en nuevas comunidades biológicas, generalmente más simples, y, consecuentemente, alteran las comunidades de patógenos, pudiendo simplificarlas hasta el punto de que alguno de los patógenos encuentre el nicho propicio para prosperar y emerger originando enfermedades en animales y/o personas. Los efectos en cascada derivados de la pérdida de la salud ecosistémica son el principal detonante de las enfermedades infecciosas emergentes, y denotan el gran servicio ecosistémico en materia de salud que aporta la conservación de los espacios naturales para el ser humano.
En las dos últimas décadas, en España se han diagnosticado diferentes enfermedades emergentes o re-emergentes en especies domésticas o en fauna silvestre, en su mayoría producidas por virus (Figura 1). La mayoría de estas enfermedades se caracterizan por ser infecciones multi-hospedador, incluyendo en su ciclo epidemiológico a diferentes especies domésticas y silvestres, y, en ocasiones, al hombre. Estas enfermedades adquieren especial relevancia por su impacto en la salud pública, por el riesgo sanitario que presentan para las especies domésticas y silvestres, por las pérdidas económicas que pueden suponer para diferentes sectores o por la amenaza inherente para la conservación de las propias especies silvestres. Por su actualidad, en este artículo incluimos como ejemplos tres enfermedades víricas emergentes detectadas en especies silvestres en la última década en España, cada una de ellas especialmente relevante por algún motivo de los anteriormente expuestos: la enfermedad hemorrágica epizoótica (EHE), la fiebre hemorrágica de Crimea-Congo (FHCC) y el moquillo.
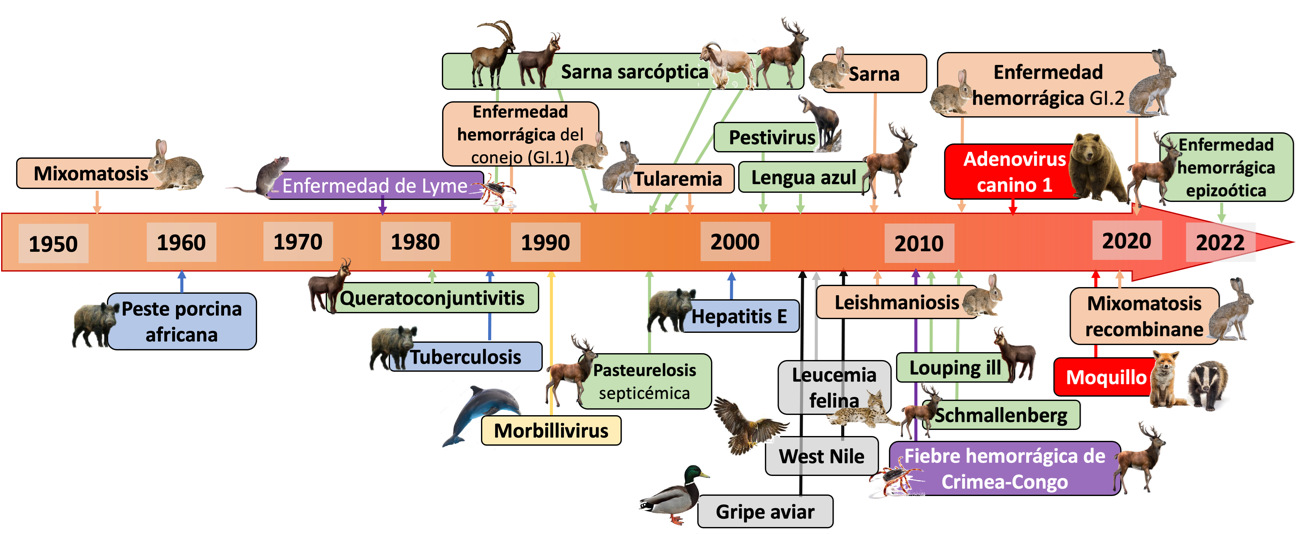
Figura 1. Evolución de los patógenos y enfermedades emergentes documentados en especies silvestres en España desde mediados del siglo XX.
Modificado de Gortázar y García Bocanegra (2022).
Enfermedad hemorrágica epizoótica: enfermedad emergente en Europa
La EHE es una enfermedad vírica infecciosa producida por un Orbivirus (familia Sedoreoviridae) con características estructurales y funcionales muy similares a las del virus de la lengua azul. El virus de la EHE (VEHE) se transmite mediante la picadura de dípteros hematófagos del género Culicoides, presentando un patrón estacional (finales de verano-principios de invierno) asociado a la actividad de estos vectores. La EHE afecta a rumiantes domésticos y silvestres, principalmente al ganado bovino y al ciervo de cola blanca (Odocoileus virginianus), y está incluida en la lista de enfermedades de notificación obligatoria de la Organización Mundial de Sanidad Animal y en la categoría D+E de enfermedades de declaración obligatoria de la Unión Europea.
El periodo de incubación del VEHE oscila entre 2 y 10 días posinfección. Clínicamente, se puede manifiestar con fiebre, anorexia, depresión, disnea, sialorrea, descarga nasal, hipoagalaxia y cojeras. Las principales lesiones asociadas a la infección por este virus son edema cefálico y cervical, inflamación de la lengua y conjuntivas, y úlceras en mucosa lingual, bucal, almohadilla dental, paladar, banda coronaria de la pezuña, rumen y abomaso. En formas agudas aparece congestión en piel y mucosas, hemorragias oronasales y congestión/hemorragia en diferentes órganos internos.
La EHE se describió por primera vez en 1955 en New Jersey (EE.UU) durante un brote con alta mortalidad en ciervo de cola blanca, aunque se conocían brotes similares desde principios del siglo XIX en EEUU. En 1959 se describió el virus de Ibaraki, más tarde englobado en el serotipo 2 del VEHE, en el ganado bovino en Japón. En los años siguientes se notificaron casos en vacuno en diferentes regiones de América, Australia, Asia y África, detectándose ciculación de diferentes serotipos (VEHE-6 y 8) en las dos últimas décadas en países del norte de África como Argelia, Túnez y Marruecos.
La EHE es la última enfermedad animal en emerger en Europa. Hasta el año 2022 no se había detectado circulación de este virus. Sin embargo, el 10 de noviembre de 2022, se confirmaron los primeros casos en bovino en la isla italiana de Cerdeña, declarándose poco después nuevos focos en Sicilia. El 18 de noviembre se confirman los primeros casos de EHE en España (Figura 2A), en concreto en los términos municipales de Jimena de la Frontera (Cádiz) y El Pedroso (Sevilla). Durante noviembre y diciembre de ese año se declararon nuevos brotes en explotaciones bovinas en las provincias de Cádiz, Sevilla, Huelva, Badajoz y Málaga. Hasta la fecha se han declarado 21 brotes de EHE en bovino en Europa, 10 en Italia y 11 en España (ADIS, 2023, https://food.ec.europa.eu/system/files/2023-01/ad_adns_overview_2022.pdf). Además, durante el mes de noviembre se confirmaron laboratorialmente infecciones por VEHE en ciervos (Cervus elaphus) (Figura 2B) en zonas de Cádiz y Sevilla próximas a las explotaciones de ganado bovino afectado.
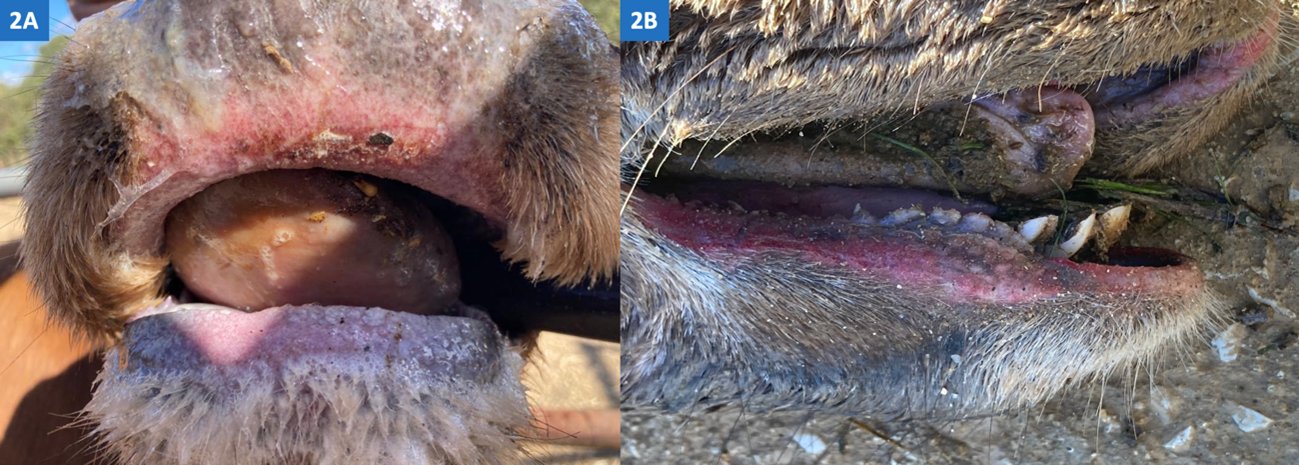
Figura 2. Lesiones en mucosa bucal asociadas a infección por virus de la enfermedad hemorrágica epizoótica en ganado vacuno (A) y ciervo (B) en España.
Autores: desconocido y Francisco Ruiz Fons.
Fiebre hemorrágica de Crimea-Congo: enfermedad emergente con potencial zoonósico
La fiebre hemorrágica de Crimea-Congo (FHCC) se documentó, casi a la par, en la península de Crimea y en la actual República Democrática del Congo en mitad del siglo XX como una grave enfermedad hemorrágica de etiología vírica que afectaba a las personas. El virus de la FHCC (VFHCC) es un Orthonairovirus transmitido por garrapatas que presenta una amplia distribución en el Viejo Mundo, donde ocasiona brotes y casos esporádicos de enfermedad que, salvo excepciones, han pasado casi desapercibidos hasta la emergencia de la enfermedad en Europa. La infección es asintomática en la mayoría de las especies animales capaces de replicar el VFHCC y transmitirlo a las garrapatas que los parasitan. La mayoría de las infecciones humanas son, igualmente, asintomáticas o de cuadro clínico leve que pasa desapercibido como un cuadro pseudogripal. Sin embargo, un número de infecciones humanas pueden cursar con una presentación clínica aguda que se manifiesta con un cuadro hemorrágico generalizado y una letalidad que oscila entre el 10 y el 40%.
El VFHCC se mantiene en un ciclo enzoótico que implica a diversas especies de animales domésticos y silvestres y, principalmente, a garrapatas del género Hyalomma que los parasitan. La infección en diversas especies animales resulta en una viremia de corta duración que permite la transmisión del virus a las garrapatas. Además, el virus puede transmitirse entre garrapatas que estén parasitando de forma conjunta a un hospedador sin necesidad de una infección sistémica en este último y mantenerse de forma prolongada en la población de garrapatas sin necesidad de hospedadores vertebrados por transmisión transovárica (vertical) y transestadial (horizontal). La transmisión del virus a humanos es fundamentalmente dependiente de la probabilidad de interacción con garrapatas infectadas, por lo que la abundancia de garrapatas que, a su vez, está condicionada por la abundancia de sus hospedadores, es un factor de riesgo primario en la aparición de casos humanos.
En España, los primeros casos de FHCC se registraron en 2016. Tras la detección retrospectiva de un caso clínico en 2013, se han notificado 11 casos primarios y un caso nosocomial de la enfermedad en el país (Badajoz, Ávila, Salamanca y León), con 4 muertes. Estudios prospectivos y retrospectivos indican la circulación enzoótica del virus en España, con un mayor riesgo en el oeste y suroeste peninsular (Figura 3), donde el virus es mantenido en las abundantes poblaciones de Hyalomma lusitanicum derivadas del notable aumento demográfico de especies de ungulados silvestres como ciervo, jabalí (Sus scrofa) o corzo (Capreolus capreolus). La demostrada relación entre la probabilidad de exposición al virus observada en ungulados silvestres y la abundancia de H. lusitanicum sugiere que la emergencia de la FHCC en España puede ser consecuencia de los cambios demográficos que los ungulados silvestres han experimentado en las últimas cinco décadas unido a los cambios climáticos que favorecen a sus vectores. Estos cambios parecen estar favoreciendo la expansión de H. lusitanicum y de otras especies del género Hyalomma en España, aumentando el riesgo de transmisión del VFHCC y la aparición de nuevos casos en territorios inesperados.
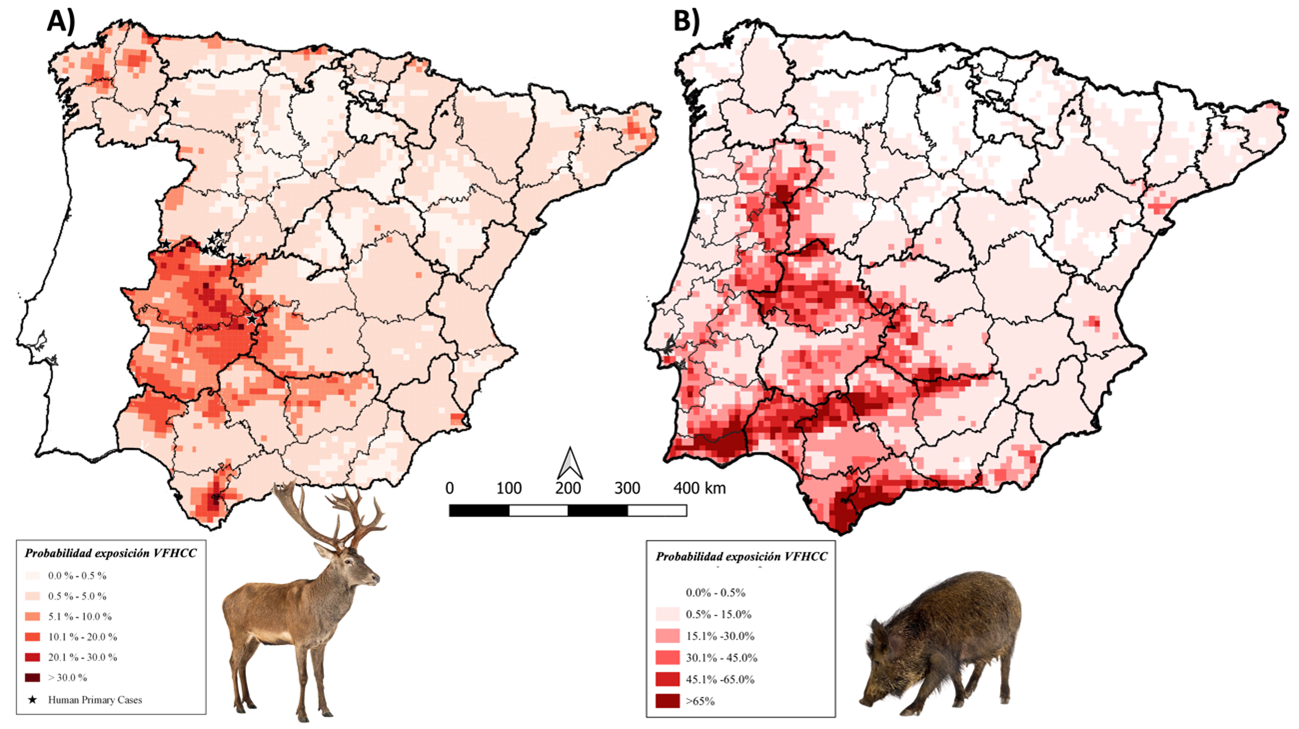
Figura 3. Proyección espacial en cuadrículas UTM de 10x10 km de modelos geográficos de riesgo de exposición al VFHCC en ciervo y jabalí en España (y Portugal).
Fuente: Cuadrado-Matías et al. 2022, doi: 10.1111/tbed.14385; Baz-Flores et al., sin publicar.
Moquillo: enfermedad emergente con impacto en fauna silvestre
El moquillo (“distemper” en inglés) es una enfermedad infecciosa descrita a principios del siglo XX (1905) por Carré en perros domésticos, que sigue siendo una de las principales enfermedades a las que deben enfrentarse los veterinarios clínicos por las altas tasas de morbilidad y mortalidad que provoca en ésta y otras especies. Su agente causal es el virus del moquillo canino (CDV), un virus del género Morbillivirus distribuido mundialmente, que afecta de forma natural y experimental a un gran número de especies de animales domésticos y silvestres. Presenta gran similitud con el virus del sarampión humano perteneciente al mismo género; de hecho, el CDV habría tenido como antecesor al virus del sarampión, habiéndose adaptado al perro en el siglo XVI en América del Sur, tras tener éstos acceso a restos de personas fallecidas a causa del sarampión (Figura 4). La enfermedad se manifiesta con diferentes signos clínicos entre los que destacan los oculo-respiratorios, digestivos, cutáneos y neurológicos, como ataxia y convulsiones. Las lesiones en animales enfermos incluyen encefalomielitis no purulenta, neumonía intersticial y depleción linfoide, entre otras. El descubrimiento de una vacuna eficaz hizo que la casuística en perros prácticamente desapareciera, sin embargo, a nivel mundial cada vez son más frecuentes los brotes registrados en mamíferos silvestres terrestres e incluso marinos, como los ocurridos en foca siberiana (Pusa sibirica) y foca del Caspio (Pusa caspica) (Figura 4). En países europeos como Dinamarca, Suiza, Bélgica e Italia, el CDV ha sido el responsable de brotes con alta mortalidad en diferentes especies de carnívoros silvestres, como el tejón (Meles meles), la garduña (Martes foina) o el zorro (Vulpes vulpes). En los últimos años, en España se han detectado brotes de mortalidad producidos por una nueva cepa de CDV (Figura 1), que ha afectado a tejones, zorros, turones (Mustela putorius), martas (Martes martes) e incluso nutrias (Lutra lutra). Hasta ese momento, los casos en España eran aislados, aunque sí se había detectado en poblaciones silvestres de zorro, lobo ibérico (Canis lupus) y lince ibérico (Lynx pardinus).
La importancia de este virus no reside únicamente en su repercusión en la conservación de especies silvestres, sino también en su potencial zoonósico en un futuro. La vacuna frente al sarampión en el ser humano protegería indirectamente frente al CDV, pero el desarrollo de enfermedad clínica en dos familias de primates no humanos, y su detección en murciélagos, preocupa cada vez más a la comunidad científica.
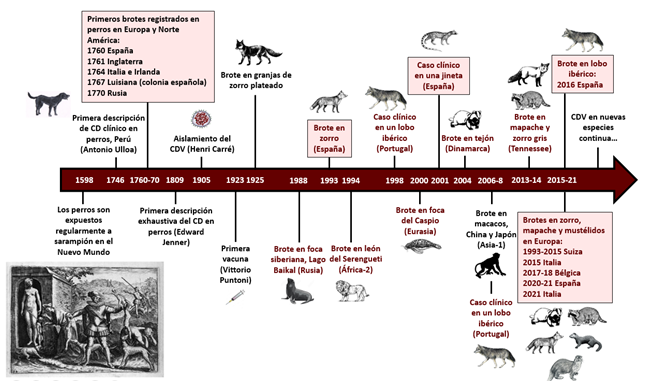
Figura 4. Principales eventos históricos relacionados con el virus del moquillo canino (CDV) desde su descubrimiento.
Los recuadros en rosa indican los brotes o casos clínicos ocurridos en España. Las letras en color granate se refieren
a brotes o casos en fauna silvestre. CD: enfermedad de moquillo. El grabado donde se observan perros alimentándose
de restos humanos corresponde a la Lámina XIII de la Narratio Regionum Indicarum, Francfort del Meno, 1598
(https://archive.org/details/narratioregionum00casa/page/34/mode/2up; Varner and Varner, 1983).
Fuente de los datos: Scopus y datos inéditos de colegas de la Red RISA. Autor: Ana Balseiro, inspirada
en Jo et al. (2019), https://doi.org/10.3390/v11100894.
Conclusiones
Entre las enfermedades emergentes y re-emergentes, las transmitidas por vectores (mosquitos, garrapatas, culicoides y flebótomos) están especialmente influenciadas por factores ambientales, dado que los patógenos causantes no sólo interaccionan con sus hospedadores vertebrados, sino que también lo hacen con artrópodos hematófagos. Los cambios climáticos y ambientales que España ha experimentado en el último medio siglo han contribuido a la expansión demográfica y espacial de numerosos vectores de enfermedad y, en consecuencia, a la expansión de los patógenos que transmiten. Resulta imaginable, especialmente si tomamos como modelo ejemplos como la fiebre del Nilo Occidental o la FHCC, que esta tendencia se incremente en el futuro con los riesgos que ello conlleva para la sanidad animal y la salud pública.
El estudio de las enfermedades (re)emergentes desde una perspectiva holística (multi, inter y trans-disciplinar) es esencial para el diseño de nuevas estrategias de prevención y lucha, siendo necesaria una comprensión integral de los agentes causales de enfermedad, las especies (humanos, animales y vectores) implicadas en los ciclos epidemiológicos, sus mecanismos de transmisión y las relaciones existentes entre ellos, sin olvidar el medio ambiente en el que se desarrolla esta compleja asociación. Esta lucha integrada debe abordarse con una perspectiva One Health (Una Salud), reconociendo la interconexión entre la salud humana, animal y del medio ambiente.
El impacto de las enfermedades señaladas en este artículo y de otras no menos importantes no se puede predecir, pero hoy tenemos las armas necesarias para vigilarlas, detectarlas y, por tanto, intentar controlarlas.
