El virus de la gripe aviar o virus de la influenza aviar (VIA) es un patógeno importante de las aves que puede también afectar a mamíferos, incluidos los seres humanos. Los brotes constantes de IA en todo el mundo preocupan no sólo la industria avícola, sino también la conservación de la fauna silvestre y la salud pública.
El VIA puede infectar una gran variedad de especies de aves domésticas y silvestres. Las aves acuáticas silvestres, en particular patos, gansos, cisnes, gaviotas y aves costeras o marinas, son los reservorios naturales de todos los VIA, genéticamente de baja patogenicidad (VIABP) (Figura 1). En estas aves reservorio, los VIABP no suelen causar enfermedad y se transmiten por la ruta fecal-oral, lo que implica que estos virus están presentes y son persistentes en el ambiente donde se encuentran estas aves. Los VIABP se pueden transmitir a aves domésticas, en las cuales producen infecciones subclínicas o leves. No obstante, al circular en aves domésticas, los VIABP de los subtipos de hemaglutinina (HA) H5 y H7 pueden mutar y devenir en VIA de alta patogenicidad (VIAAP), que suelen causar enfermedad sistémica grave con elevada mortalidad en gallináceas (Galliformes). Ciertas prácticas que permiten el contacto directo con aves silvestres o sus heces pueden facilitar que las aves domésticas se vean expuestas a los VIABP, como la cría al aire libre o las granjas con baja bioseguridad. Además, los mercados de aves vivas son elementos clave en la emergencia, mantenimiento y propagación de los VIA.
A diferencia de los VIABP, los VIAAP no suelen estar presentes en los reservorios naturales. Sin embargo, esta situación cambió drásticamente con la aparición del linaje H5 Goose Guangdong (Gs/GD) de VIAAP en el sureste de Asia en 1997, el cual se estableció en poblaciones de aves silvestres migratorias, causando mortalidades en estas poblaciones y diseminando el virus a través de sus rutas migratorias, infectando de nuevo a aves domésticas de múltiples continentes y, ocasionalmente, a los humanos.
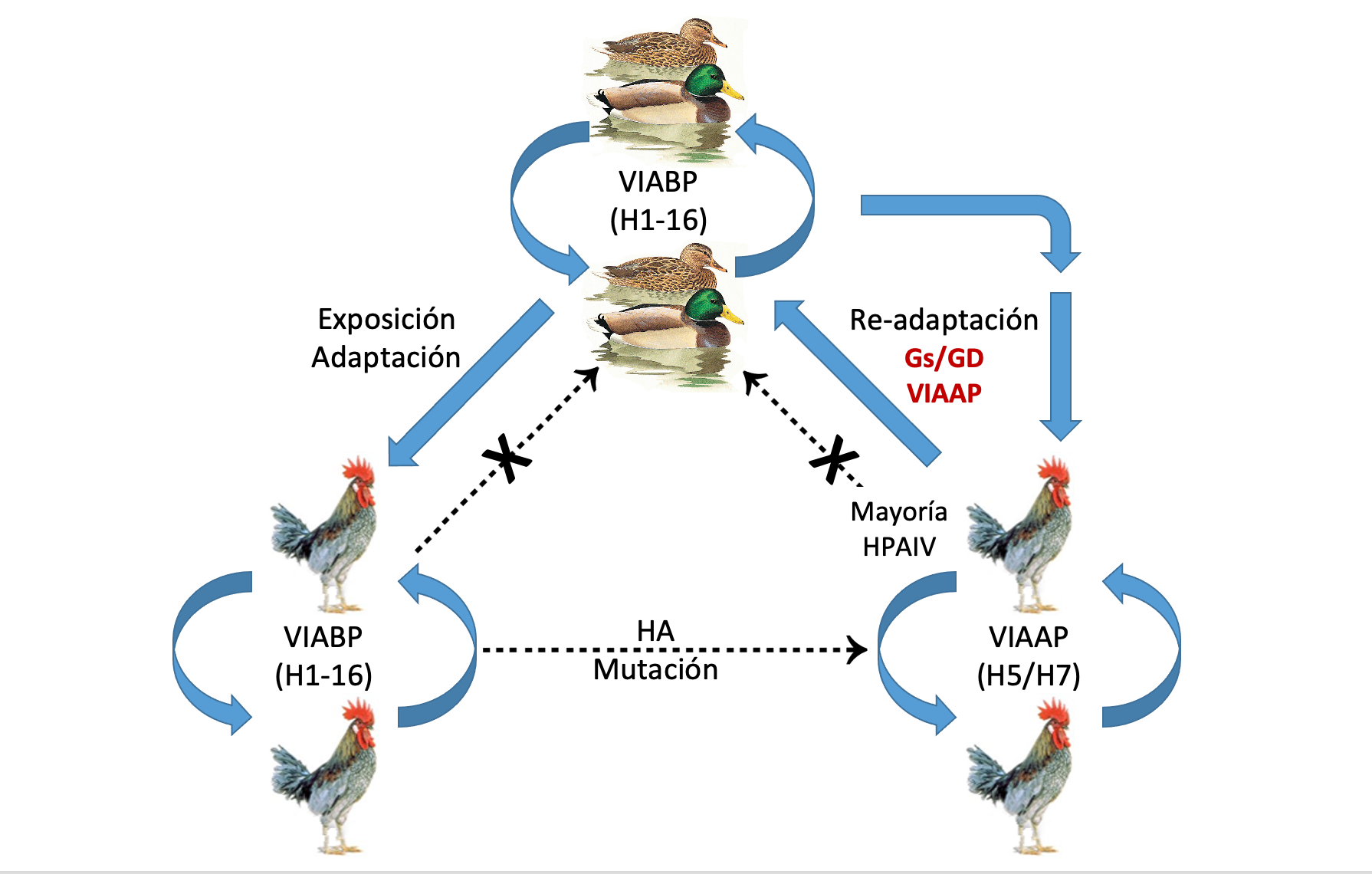
Figura 1. Epidemiología de los VIA que circulan entre aves silvestres y aves domésticas. Fuente: adaptado de Sims et al., 2016
Desde su aparición en 1997, el linaje Gs/GD se ha diversificado genéticamente en diferentes clados y subclados. En concreto, el clado 2.3.4.4 apareció en 2014 y se ha propagado rápidamente a través de aves acuáticas migratorias, causando brotes sin precedentes en aves domésticas y silvestres en Asia, Europa, América del Norte y África.
Desde 2014, los VIAAP H5 clado 2.3.4.4b han dominado los brotes en Europa. La epizootia del 2016-2017 se considera la más devastadora de la historia del continente europeo, con más de 1.200 brotes en aves domésticas y más de 1.600 en aves silvestres, siendo Francia y Hungría algunos de los países más afectados. En España, los 10 brotes por VIAAP H5N8 clado 2.3.4.4b declarados en 2016-2017 en aves domésticas involucraron explotaciones de patos en la provincia de Girona (Cataluña). Aunque los estudios epidemiológicos no han dado resultados concluyentes, el origen más plausible de los brotes es el del contacto con aves silvestres, como lo demuestra la concurrencia de la detección del mismo virus en una cigüeña (Ciconia ciconia) encontrada muerta en los Aiguamolls de l'Empordà (Girona, Cataluña).
Desde la epizootia del 2016-2017, las incursiones de VIAAP H5Nx Gs/GD en Europa se han repetido invierno tras invierno, todas ellas siguiendo el mismo patrón de introducción del virus mediante aves acuáticas migratorias, persistencia viral en el ambiente y exposición a aves silvestres residentes y aves domésticas, principalmente en granjas de cría extensiva. El control de estos brotes conlleva el sacrificio de millones de aves domésticas y restricción de movimientos de aves y productos avícolas. Tales medidas de estricto control son efectivas para controlar la propagación de la enfermedad, pero tienen un impacto económico y social dramático para el sector avícola y para la sociedad en general.
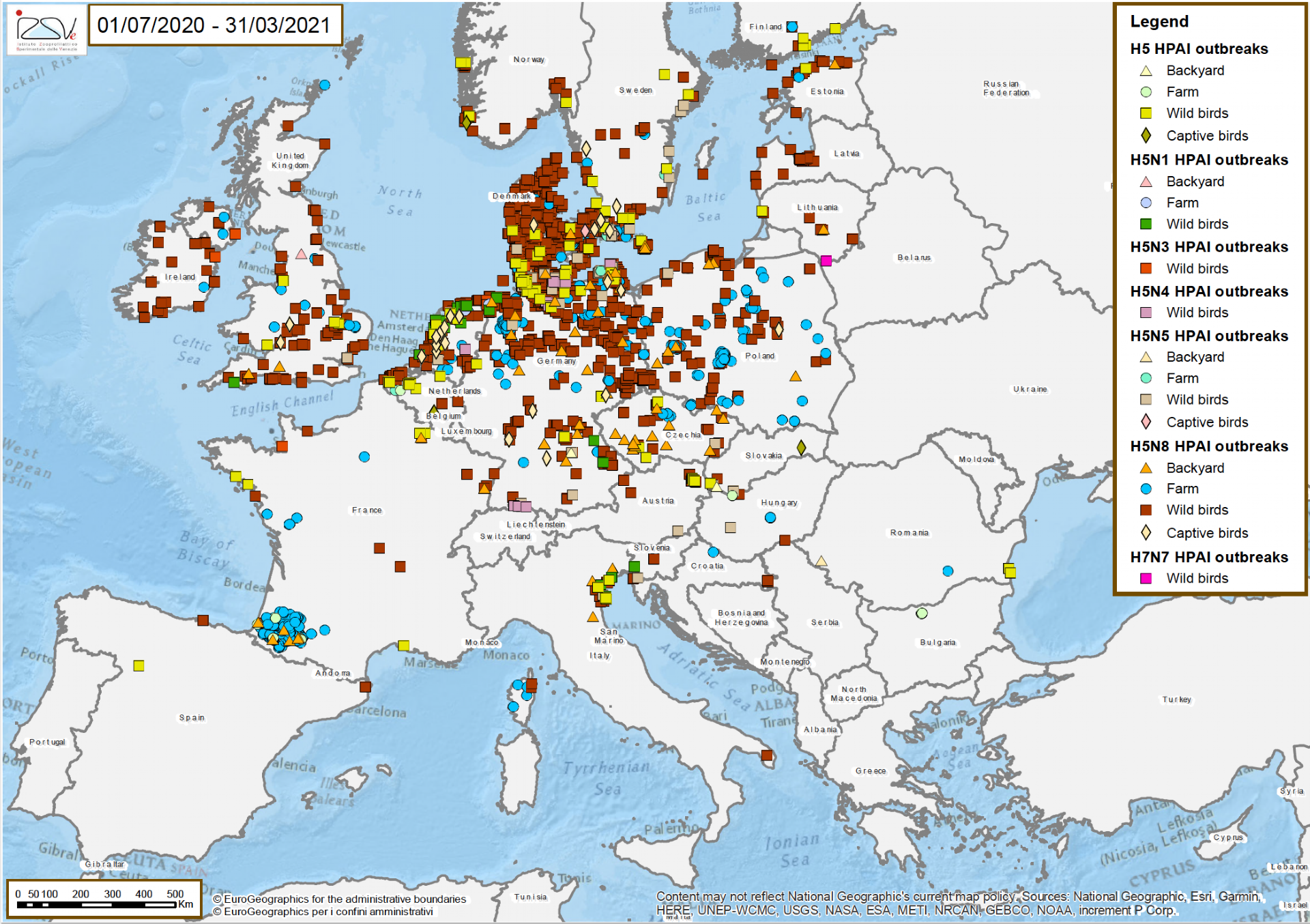
Figura 2. Mapa de los brotes de VIAAP en Europa (última actualización: 31/03/2021). Fuente: IZSVe.
Desde octubre de 2020 y hasta fecha del 31 de marzo de 2021, varios países europeos se han visto afectados por casos de VIAAP H5Nx clado 2.3.4.4b (Figura 2). La mayoría de las detecciones han sido en aves silvestres (más de 1880), principalmente aves acuáticas como patos, gansos y cisnes (Anseriformes), pero también en aves rapaces. La mayoría de las aves habían sido encontradas muertas o moribundas, aunque también hay casos de infección por VIAAP en patos o gansos aparentemente sanos. Se han notificado más de 800 brotes de VIAAP en aves domésticas, siendo la fuente más probable de infección el contacto indirecto con aves silvestres infectadas. Francia es el país más afectado con más de 480 brotes, la mayoría en granjas de patos de producción de foie gras localizados en la región de las Landas. Por su largo ciclo productivo en extensivo, este tipo de producciones tienen mayor riesgo de exposición a aves silvestres o a ambientes contaminados por el virus.
Debido a la presencia continua de VIAAP H5Nx en aves silvestres y el medio ambiente, todavía existe un alto riesgo de introducción y propagación del virus en Europa en los próximos meses. Ante esta realidad epidemiológica, resulta de suma importancia mantener una vigilancia y bioseguridad elevada y sostenible, especialmente en las zonas de alto riesgo.
El 20 de febrero, las autoridades rusas notificaron la infección por VIAAP H5N8 clado 2.3.4.4b en siete trabajadores de una granja del sur de Rusia, afectada por el virus. A pesar de la alarma inicial, los siete casos humanos fueron asintomáticos, no hay evidencia de transmisión entre personas, y no se ha observado la presencia de mutaciones asociadas a potencial zoonótico en los VIAAP que circulan actualmente en Europa. Por todas estas razones, la ECDC determina que el riesgo de infección por VIAAP para la población general es muy bajo y para los trabajadores expuestos a aves infectadas es bajo. No obstante, la continua circulación del virus y el elevado número de explotaciones domésticas afectadas hace que el riesgo de exposición a las personas sea elevado.
Tras la transmisión zoonótica en Rusia, recientemente se detectaron infecciones por VIAAP H5N8 en varias focas y un zorro en un centro de recuperación de fauna silvestre en Reino Unido, lo que supone otro evento inusual de transmisión de aves a mamíferos. Se cree que los mamíferos se infectaron por contacto con cisnes del centro que también dieron positivo al virus.
La Península Ibérica se encuentra estratégicamente ubicada en lo que se refiere a las vías migratorias, y muchos de sus humedales son importantes puntos de parada para la reproducción e invernada de las aves migratorias entre Eurasia y África. Así, en base al censo de aves acuáticas y a su proximidad a zonas de producción avícola densamente pobladas, los humedales se consideran zonas con alto riesgo de brotes de IA y es donde se intensifica la vigilancia de IA. En Cataluña, la Generalitat realiza la vigilancia de VIA en aves silvestres en colaboración con IRTA-CReSA.
En lo que llevamos de la epizootia actual 2020-2021, en España se han reportado tres brotes de VIAAP H5N8 clado 2.3.4.4b en aves silvestres por vigilancia pasiva: un halcón peregrino (Falco peregrinus) en las Marismas de Santoña (Cantabria, 27 de noviembre 2020), tres cigüeñas y un ánsar común (Anser anser) en los Aiguamolls de l’Empordà (Cataluña, 5 de enero 2020), y un ánsar común en las Lagunas de Villafáfila (Zamora, 27 de enero 2021). Estas detecciones han alertado a las explotaciones avícolas de las zonas adyacentes, especialmente las que practican ganadería extensiva, pero hasta la fecha no se han detectado brotes en aves domésticas.
Desde 2007, y con la financiación de proyectos competitivos Estatales, estos tres centros de investigación de la Red RISA colaboran investigando el VIA desde diferentes puntos de vista: ecología, epidemiología, patogenia, interacción hospedador-patógeno, y diagnóstico, entre otros.
Debido a la importancia que juegan los humedales en la transmisión de la enfermedad, el grupo Virus Aviares del IRTA-CReSA (Cataluña) está investigando el papel que la persistencia del VIA en el agua podría jugar en la epidemiología del virus. Hasta la fecha, diversos estudios demuestran que el virus puede persistir largos períodos (desde semanas hasta meses, dependiendo de las condiciones de temperatura y salinidad) en el agua, facilitando su transmisión a nuevos grupos de aves. No obstante, la mayoría de estos estudios se han realizado en condiciones de laboratorio alejadas de la realidad. Por ello, el grupo de investigación sobre Virus Aviares del IRTA-CReSA está realizando estudios de persistencia ambiental del virus utilizando un mesocosmos de ríos: un sistema experimental que estudia el entorno natural bajo condiciones controladas que, por lo tanto, reproduce las condiciones reales de un río. Esta línea de investigación se realiza en colaboración con el ICRA (Instituto Catalán de Investigación del Agua), que ha prestado sus fantásticas instalaciones y experiencia en el estudio del agua (Figura 3).
Las investigaciones en IRTA-CReSA abarcan también diversos aspectos de la interacción entre el VIA y su hospedador, aprovechando sus instalaciones de alta seguridad biológica en el campus de Bellaterra de la UAB (Cataluña). Recientemente, IRTA-CReSA evaluó la susceptibilidad a la infección por dos VIAAP (H7N1 clásico y H5N8 clado 2.3.4.4b) en diferentes razas de pollos locales y comerciales españolas. Se confirmó que existe variación en la susceptibilidad a los VIAAP entre las diferentes razas de pollos en cuanto a signos clínicos, mortalidad y excreción viral. Del mismo modo, se demostró que el virus H5N8 clado 2.3.4.4b es muy virulento para los gansos domésticos, mientras que el virus H7N1 clásico puede infectar a estas aves, pero no es virulento para esta especie (Figura 4). Estos resultados contribuyen a explicar el por qué de la elevada incidencia de brotes de VIAAP en explotaciones de anátidas en Francia, debiéndose no solo al riesgo intrínseco del sistema de producción extensivo sino también a la elevada susceptibilidad de estas especies a los VIAAP clado 2.3.4.4b.
Finalmente, y en un intento de entender mejor la patogenia de estos virus, IRTA-CReSA está estudiando las diferencias existentes a nivel transcriptómico entre aves resistentes y susceptibles infectadas, así como la evolución del virus en ambos grupos de aves para determinar la adaptación del virus frente a las barreras del hospedador.
La bioseguridad en las explotaciones avícolas es clave para prevenir brotes de VIA. Sin embargo, en muchos casos la vía de infección de las aves de producción sigue siendo una incógnita, especialmente en aves mantenidas en el interior de naves. Dado que las aves acuáticas raramente suelen entrar en contacto directo con las aves de granjas avícolas, las llamadas especies “puente” cobran especial importancia. Estas especies puente son aves que pueden infectarse con VIABP por contacto con las aves acuáticas o agua contaminada y que, por ejemplo en el caso de pequeños paseriformes como el gorrión común (Passer domesticus) o el estornino negro (Sturnus unicolor), entran fácilmente en las naves de producción, pudiendo contaminar a su vez el pienso o las superficies con sus excrementos, una posibilidad que ya ha sido demostrada experimentalmente. El incremento de los sistemas de aves de puesta con acceso al exterior puede aumentar este riesgo, así como los sistemas de producción de aves cinegéticas para consumo y suelta en terrenos cinegéticos. De hecho, investigadores del IRTA-CReSA y el Grupo SaBio (Sanidad y Biotecnología) del IREC (CSIC-UCLM) (Castilla – La Mancha) han podido demostrar experimentalmente la susceptibilidad de la perdiz roja (Alectoris rufa) a la infección por VIA.

Figura 3. Canales experimentales de las instalaciones de ICRA. Fuente: ICRA.

Figura 4. Infección experimental en gansos domésticos. Fuente: IRTA-CReSA.
Dado que aún no existe información concluyente sobre la importancia de la transmisión por vía de la avifauna peri-doméstica, el grupo SaBio del IREC trabaja en la caracterización de la interfaz entre las aves domésticas y las aves silvestres mediante la combinación de foto trampeo, captura y muestreo directo de las aves, y telemetría (Figura 5). La combinación de estas metodologías permite determinar la composición de la (avi)fauna silvestre que frecuenta los diferentes sistemas de producción avícola, estudia la conectividad que estas aves proporcionan con humedales u otras granjas, y determina el grado de intercambio de patógenos, incluido VIABP, entre las aves silvestres y domésticas con el fin de evaluar los riesgos e implementar medidas de bioseguridad efectivas. Al mismo tiempo, el grupo estudia cómo el hecho de vivir en ambientes contaminados afecta la susceptibilidad de las aves urbanas a los VIABP, con el fin de revelar si existe un mayor riesgo de que estas aves se conviertan en reservorio del virus y puedan incluso transmitirlo a otras aves o a personas, como así ocurre ocasionalmente con VIA del subtipo H7N9 en el sureste asiático.
En un trabajo llevado a cabo en colaboración entre los tres grupos, se estudiaron los factores que intervienen en la ecología y epidemiología de los VIA en los humedales. Así, tras muestrear siete humedales de variadas características en diferentes regiones de la Península Ibérica, se determinó que la prevalencia de VIA seguía el mismo patrón en todos ellos y que los factores que explican su variabilidad estaban relacionados con la combinación de variables espaciales y temporales, factores meteorológicos y la composición de la comunidad de aves. Posteriormente, NEIKER (País Vasco), en colaboración con el IREC, llevó a cabo un estudio longitudinal sobre la epidemiología de los VIA en un pequeño humedal peri-urbano con presencia continuada de gran diversidad de subtipos de VIA. Se observaron patrones estacionales y anuales en la prevalencia de VIA y se puso en evidencia que su fluctuación a largo plazo se asociaba a la comunidad de Anseriformes reproductores, observándose una disminución de la prevalencia de VIA cuando disminuían las parejas de Anseriformes reproductores. Estos resultados son de gran relevancia para valorar el papel de la ecología del hospedador en la transmisión de patógenos cuando se trata de prevenir y gestionar futuros brotes de IA. Adicionalmente, un estudio realizado conjuntamente entre el IREC y NEIKER ha permitido demostrar que ambientes humanizados como vertederos pueden también convertirse en escenarios de transmisión del VIA entre aves y que pueden servir de puntos para la obtención de muestras no invasivas para la vigilancia de VIA.
Un estudio independiente, pero relacionado con lo recién descrito, ha permitido determinar que las aves silvestres naturalmente infectadas con VIABP tienen más probabilidades de ser también positivas a Mycobacterium spp. y Salmonella spp., lo cual refuerza el interés de estudiar las comunidades microbianas en su conjunto.
NEIKER tiene una amplia experiencia en el desarrollo y la puesta a punto de diversas técnicas para la detección de agentes patógenos (Figura 6). En relación con el VIA, se trabaja en optimizar el aislamiento y tipado de los virus detectados mediante RT-PCR. Así, un ensayo comparativo de nueve protocolos diferentes para el cultivo de VIA sugiere que el uso de huevos embrionados de pato doméstico podría ser una alternativa eficaz para ser utilizada con algunos subtipos de VIA que no crecen bien en los de pollo. Además, las membranas amnióticas y vitelinas mostraron tasas de aislamiento más altas que el líquido alantoideo usado tradicionalmente.
La larga y productiva colaboración entre IRTA-CReSA, IREC y NEIKER ejemplifica la importancia de la investigación colaborativa, multidisciplinar y estable en el tiempo para avanzar en el conocimiento de la IA.

Figura 5. Estornino negro con transmisor antes y después de ser liberado. Fuente: IREC. Autor: Teresa Cardona.
Figura 6. Inoculación de huevos embrionados SPF para aislamiento viral. Fuente: NEIKER.
● Los brotes de IA pueden incidir negativamente tanto en la industria avícola y en la conservación de la fauna silvestre como en la salud pública.
● Desde la epizootia del 2016-2017 (la más devastadora del continente europeo hasta la fecha), las incursiones de VIAAP H5Nx Gs/GD en Europa se han sucedido cada invierno siguiendo el mismo patrón: introducción del virus mediante aves acuáticas migratorias, persistencia viral en el ambiente y exposición a aves silvestres residentes y aves domésticas.
● Desde octubre de 2020, varios países europeos se han visto afectados por casos de VIAAP H5Nx clado 2.3.4.4b. El número de brotes y la implicación de las aves silvestres recuerda la epizootia del 2016-2017. Resulta de suma importancia mantener una vigilancia y bioseguridad elevada y sostenible.
● Recientemente se notificó la infección por VIAAP H5N8 clado 2.3.4.4b en siete trabajadores de una granja de Rusia. No obstante, se considera que el riesgo de infección por VIAAP para la población general es muy bajo y para los trabajadores expuestos a aves infectadas es bajo.
● Los humedales de la Península Ibérica se consideran zonas con alto riesgo de brotes de IA y es donde se intensifica la vigilancia de IA
● Desde 2007, IRTA-CReSA, IREC y NEIKER colaboran investigando y avanzando en el conocimiento del VIA desde diferentes áreas de especialización.
Artículos y enlaces de interés
Autores
Albert Perlas 1,2, Marta Barral 3, Úrsula Höfle 4,5, Natàlia Majó 1,2, Kateri Bertran 1
1 IRTA, Centre de Recerca en Sanitat Animal (CReSA, IRTA-UAB), Campus de la Universitat Autònoma de Barcelona (UAB), Bellaterra, España
2 Departament de Sanitat i Anatomia Animals, Universitat Autònoma de Barcelona, Campus de la Universitat Autònoma de Barcelona (UAB), Bellaterra, España
3 NEIKER-Instituto Vasco de Investigación y Desarrollo Agrario, Departamento de Sanidad Animal, Parque de Ciencia y Tecnología de Bizkaia 812L, 48160 Derio (Bizkaia), España
4 Grupo SaBio, Instituto de Investigación en Recursos Cinegéticos (IREC), CSIC-UCLM-JCCM, Ronda de Toledo 13005 Ciudad Real, España
5 Escuela de Ingenieros Agrónomos, Ronda de Calatrava, 13071 Ciudad Real, España
